ALERGOLOGÍA
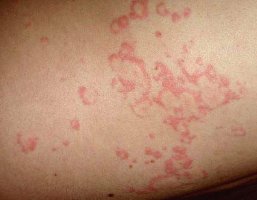
La urticaria afecta al 13% de la población española
JANO.es y agencias · 26 octubre 2007
Especialistas en alergología y dermatología debaten en Santander sobre el futuro de los tratamientos de las alergias cutáneas
El Premio Nobel de Química de 1988 Robert Huber, uno de los pioneros del análisis estructural y funcional de las proteínas, apuesta decididamente por la investigación en proteómica. Ya lo hizo antes de 1988, año en el que recibió el citado galardón por sus investigaciones en la determinación de la estructura tridimensional del proceso de fotosíntesis, "el proceso biológico probablemente más importante y visible de todos los que ocurren en nuestro planeta --de hecho se aprecia desde el espacio--. Es una reacción de la que depende la vida", señaló el Prof. Huber durante una conferencia pronunciada en la Fundación Ramón Areces de Madrid.
Hace 15 años su grupo pretendía analizar el proceso básico de la conversión de la luz en energía. Se trataba de conocer la estructura de la fotocélula biológica; para ello, desarrolló un innovador sistema de cristalografía que sirvió para comprender muchos de los procesos que estaban ocurriendo: "empezamos a saber más cosas de la estructura de la proteína --recuerda el Nobel--, la síntesis biológica, etc.; y vimos por primera vez una proteína integral de la membrana".
En realidad, como reconoció el Prof. Huber, su trayectoria investigadora es muy similar a la de otros científicos. "Mi historia en la investigación es bastante típica: se trata de hacer investigación básica en biología con el objetivo de conocer los fenómenos biológicos que, en un futuro, pueden tener aplicaciones médicas. Ésto, en algunos casos, puede llevar a la creación de una compañía biotecnológica, una spin-off --empresas que se crean en el seno de otra empresa o entidad ya existente y que en la mayoría de los casos surgen de las universidades o los centros de investigación públicos". De hecho, en 1998 el Prof. Huber participó en la formación de una compañía biotecnológica --Proteros Biostructures--, una de cuyas funciones es determinar estructuras diana para las grandes compañías biomédicas.
¿Qué cuentan las proteínas?
En los últimos años se ha insistido en la gran importancia que tiene la investigación en genómica. Se han almacenado muchos datos sobre genes. Sin embargo, se pregunta el Premio Nobel, "¿qué tipo de información ofrece una secuencia genómica como ATGCATGCATGCATGCATGCATGCATGCATGCATGCATGCA? No ofrece ningún dato relevante sobre la función de las proteínas para las que codifican los genes. Por ejemplo, una mariposa y su larva tienen el mismo genoma: sin embargo, su aspecto y fisiología es totalmente diferente; es decir, el proteoma o repertorio de proteínas que define un organismo vivo es totalmente diferente".
Pero el Prof. Huber va más lejos, "incluso si conocemos la secuencia proteómica no sabemos apenas nada sobre la función; empezamos ahora a comprender si este código se traduce en una molécula de proteína de verdad con su estructura en 3D. Sólo si conocemos las proteínas y sus interacciones a este nivel comenzaremos a tener una idea de cómo funciona la vida".
Para determinar esta estructura en 3D hace falta cristalografía de rayos X, un sistema muy complejo de análisis de proteínas. En la actualidad, este investigador está considerado como uno de los mayores expertos mundiales en el uso de la difracción de rayos X para determinar la estructura atómica de moléculas complejas, como las proteínas. Estos trabajos podrían tener una aplicación médica en un futuro no muy lejano. Hace 100 años el Prof. Emil Fisher sentó los cimientos de esta línea de investigación con el principio de llave, de cierre, bloqueo o unión de ligando a una proteína. "Cada proteína tienen un lugar de unión determinado en el que se encaja una molécula; si conocemos dicha estructura del cierre podríamos diseñar una llave y, a posteriori, sintetizar compuestos, inhibidores, etc.", explicó el Premio Nobel.
|
Robert Huber, nota biográficas Bioquímico alemán nacido en 1937 en Munich, Alemania, obtuvo el doctorado en la Universidad Técnica de su ciudad natal y en 1972 pasó a la dirección de la rama de bioquímica del Instituto Max Planck de Martinsried, donde permaneció 4 años. En 1976 volvió a la Universidad Técnica como docente de química y en 1987 regresó al Max Planck. En 1985 Huber y sus colegas alemanes J. Deisenhofer y H. Michel descubrieron la estructura completa de la proteína que se encuentra en la base del proceso de fotosíntesis, capaz de convertir la energía luminosa en energía química. Cuando les fue concedido en 1988 el Premio Nobel de Química “por haber determinado la estructura de un centro de reacción fotosintética”, la Academia también hizo constar que “habían sido los primeros en desentrañar los detalles de la construcción de la proteína y en revelar la estructura de la molécula átomo por átomo”, para lo cual habían tenido que utilizar los rayos X de difracción, una técnica en la que el Prof. Huber es reconocido internacionalmente como un gran experto. Además, es un especialista en la determinación de la estructura tridimensional de las proteínas, muchas de las cuales son muy importantes en los procesos fisiológicos que se ven alterados por determinadas enfermedades: “Necesitamos entender dichos procesos y conocer en detalle la estructura de las proteínas para elaborar fármacos. Y ese conocimiento es el resultado de muchos años de investigación, de aislar los componentes, de elegir aquellos que sean más activos e intentar reproducirlos artificialmente”, explica el Prof. Huber. |
Anticuerpos y sus receptores
Las investigaciones de este experto también se han dirigido al estudio de anticuerpos y receptores de anticuerpos, esenciales en la respuesta inmunitaria. "Hace 4 años, cuando empezamos, queríamos tener más información sobre, por ejemplo, los receptores Fc. Ahora, ya sabemos que las proteínas no son rígidas, tienen movilidad y se pueden adaptar a distintos entornos".
Su grupo centra en estos momentos parte de sus trabajos científicos en la proteína MOG (Glucoproteína mielínica oligodendrocitaria), implicada en la esclerosis múltiple. "Sabemos que MOG, una proteína integral de la membrana de la vaina de mielina, es un autoantígeno dominante. Además, se ha descubierto en pacientes con esclerosis múltiple como autoanticuerpo dominante; si analizamos su sangre tenemos un autoanticuerpo dirigido contra esta proteína MOG. Por eso, nuestros trabajos se han dirigido a conocer cómo este autoanticuerpo interacciona con MOG".
Según explicó el Prof. Huber, si fuera posible desarrollar por síntesis un autopéptido mimético con dicha configuración competiría con MOG y, eventualmente, ofrecería una nueva estrategia terapéutica para combatir la esclerosis múltiple, al menos para aquellos pacientes donde éste sea el autoantígeno dominante.
|
Más que fotosíntesis El centro de reacción fotosintética bacteriano detallado por los Prof. Huber, Michel y Deisenhofer, trabajo por el que obtuvieron en Premio Nobel de Química en 1988, no sólo posibilitó un mayor conocimiento del mecanismo de la fotosíntesis —proceso de conversión de la luz solar en la energía química necesaria para llevar a cabo la respiración celular—, sino que también clarificó los principios por los que se rigen las estructuras proteicas insertas en membranas celulares, caso de las bombas de iones y otras proteínas de transporte. Aún en la actualidad, la estructura del centro de reacción es considerada como una herramienta indispensable por los químicos teóricos para comprender cómo la transferencia de electrones en sistemas biológicos puede llevarse a cabo a muy altas velocidades —incluso a una billonésima de segundo— entre largas distancias —más de 10 átomos— a nivel molecular. |
Autopéptido mimético
No obstante, éste no es más que uno de los mútiples usos de la aplicación de la investigación a la clínica. "También nos gustaría, por ejemplo, interferir, a través de diversas formas, con la interacción de anticuerpos con sus receptores Fc a través, por ejemplo, del diseño de pequeñas moléculas que impidan ese contacto; otra opción es crear anticuerpos dirigidos frente al Fc o el receptor, lo que impediría la unión entre el receptor Fc y el anticuerpo. Por último, se podrían hacer receptores solubles que competirían con el anticuerpo e impedirían la activación celular".
Para este científico, "se podría decir que el futuro ya está aquí. Algunos modelos en los que está trabajando su grupo son la artritis reumatoide, el lupus eritematoso sistémico, la alveolitis o la citada esclerosis múltiple. "En definitiva, la idea básica es impedir el estímulo inmunitario y para ello diseñamos moléculas pequeñas que interfieran en el proceso".
 Medicina y humanidades
Medicina y humanidades