ENFERMEDADES INFECCIOSAS
Reino Unido es el primer país que aprueba el antiviral molnupiravir contra la COVID-19
Europa Press · 05 noviembre 2021
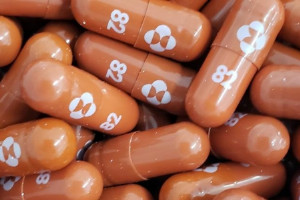
La Agencia Reguladora de Medicamentos y Productos Sanitarios de Reino Unido (MHRA) ha avalado el uso del antiviral molnupiravir, comercializado como Lagevrio, para reducir el riesgo de hospitalización y muerte en personas con COVID-19 leve a moderada que tienen un mayor riesgo de desarrollar una enfermedad grave.
"Es el primer antiviral aprobado en el mundo frente a la COVID-19 que puede tomarse por vía oral en lugar de administrarse por vía intravenosa. Esto es importante porque significa que puede administrarse fuera de un entorno hospitalario, antes de que la enfermedad haya progresado hasta una fase grave", ha destacado la directora ejecutiva de la MHRA, June Raine.
Desarrollado por Ridgeback Biotherapeutics y MSD, el fármaco actúa interfiriendo en la replicación del SARS-CoV-2. Esto impide que se multiplique, manteniendo bajos los niveles del virus en el organismo y, por tanto, reduciendo la gravedad de la enfermedad.
Según los datos de los ensayos clínicos, el molnupiravir es más eficaz cuando se toma durante las primeras fases de la infección, por lo que la MHRA recomienda su uso lo antes posible después de dar positivo y en los cinco días siguientes a la aparición de los síntomas.
El molnupiravir ha sido autorizado para su uso en personas que tienen COVID-19 leve a moderada y al menos un factor de riesgo de desarrollar una enfermedad grave. Estos factores de riesgo son obesidad, edad superior a 60 años, diabetes mellitus o enfermedades cardiacas.
En los ensayos clínicos, el fármaco resultó ser eficaz para reducir en un 50 por ciento el riesgo de hospitalización o muerte en adultos de riesgo no hospitalizados con COVID-19 leve a moderada. "Sobre la base de estos y otros datos que han sido cuidadosamente revisados, está claro que Lagevrio es otro tratamiento seguro y eficaz para ayudarnos en nuestra lucha contra la COVID-19", ha declarado el presidente de la Comisión de Medicamentos de Uso Humano de Reino Unido, Munir Pirmohamed.
Mientras tanto, la FDA de Estados Unidos está revisando la solicitud de autorización de uso de emergencia del fármaco, lo mismo que la Agencia Europea de Medicamentos (EMA), que ha iniciado una revisión continua.
 Medicina y humanidades
Medicina y humanidades